INTRODUCCIÓN A SOLUCIONES
Soluciones
Solución o disolución: Es un sistema homogéneo, fraccionable, formado por dos o más sustancias puras miscibles. Es homogénea porque no es posible distinguir el soluto una vez disuelto en el solvente. Por ejemplo, al colocar sal en agua, para formar el suero fisiológico, no es posible distinguir la sal disuelta. Se forman así iones hidratados que se mueven libremente en el seno del agua. A este tipo de soluciones se las denomina iónicas, y se caracterizan por conducir la corriente eléctrica. Distinto es el caso de las soluciones llamadas moleculares, en donde las moléculas de soluto no se hidratan y conservan su individualidad. No conducen la corriente eléctrica, ya que el soluto no se ioniza. Ejemplos: la solución de cloruro de sodio en agua es iónica, mientras que si se disuelve azúcar en agua se obtiene una solución molecular Como se estudió anteriormente en toda solución el componente que se encuentra en mayor cantidad se denomina solvente o disolvente, y los que se encuentran en menor cantidad constituyen los solutos. Ejemplo: Si se mezclan 10 gramos de alcohol con 90 gramos de agua, el alcohol es el soluto y el agua el solvente en la solución formada. De la misma forma, si la mezcla contiene 10 gramos de agua y 90 gramos de alcohol el solvente es el alcohol y el soluto el agua
Solvente
Soluto
El soluto es el componente de una solución que se encuentra en menor cantidad. También conocida como la sustancia que se disuelve. Por lo que se puede encontrar en un estado de agregación diferente al comienzo del proceso de disolución y experimentar una transición de fase. Por ejemplo: los solutos sólidos (como azúcar) disueltos en un solvente líquido (agua), lo que origina una solución líquida (solución azucarada para hipoglucemias).
Tipos de soluciones
Las soluciones químicas pueden clasificarse de acuerdo a dos criterios.
La proporción entre el soluto y el disolvente:
- Diluidas. Cuando la cantidad de soluto respecto al solvente es muy pequeña. Por ejemplo: 1 gramo de azúcar en 100 gramos de agua.
- Concentradas. Cuando la cantidad de soluto respecto al solvente es grande. Por ejemplo: 25 gramos de azúcar en 100 gramos de agua.
- Saturadas. Cuando el solvente no acepta ya más soluto a una determinada temperatura. Por ejemplo: 36 gramos de azúcar en 100 gramos de agua a 20 °C.
- Sobresaturadas. Como la saturación tiene que ver con la temperatura, si incrementamos la temperatura, se puede forzar al solvente a tomar más soluto del que ordinariamente puede, obteniendo una solución sobresaturada (saturada en exceso, digamos). Así, sometida a un calentamiento, la solución tomará mucho más soluto del que ordinariamente podría.
El estado de agregación de los componentes:
Sólidas:
- Sólido en sólido. Tanto el soluto como el disolvente se encuentran en estado sólido. Por ejemplo: las aleaciones como el latón (cobre y zinc).
- Gas en sólido. El soluto es un gas y el disolvente es un sólido. Por ejemplo: hidrógeno en paladio, polvo volcánico, entre otros.
- Líquido en sólido. El soluto es un líquido y el disolvente es un sólido. Por ejemplo: las amalgamas (mercurio y plata)
Líquidas:
- Sólido en líquido. Por lo general, se disuelven pequeñas cantidades de sólido (soluto) en un líquido (disolvente). Por ejemplo: azúcar disuelto en agua.
- Gas en líquido. Se disuelve un gas (soluto) en un líquido (disolvente). Por ejemplo: el oxígeno disuelto en el agua de mar que es responsable de la vida acuática en el planeta.
- Líquido en líquido. Tanto el soluto como el disolvente son líquidos. Por ejemplo: las amalgamas (mercurio y plata)
Gaseosas:
- Gas en gas. Tanto el soluto como el disolvente son gases. En muchas ocasiones estas disoluciones se asumen como mezclas debido a las débiles interacciones entre las partículas de los gases. Por ejemplo: oxígeno en aire.
- Gas en sólido. El soluto es un gas y el disolvente es un sólido. Por ejemplo: polvo disuelto en aire.
- Líquido en gas. El soluto es un líquido y el disolvente es un gas. Por ejemplo: vapor de agua en el aire.
Concentración de una solución química
La concentración es una magnitud que describe la proporción de soluto respecto al solvente en una disolución. Esta magnitud se expresa en dos tipos distintos de unidades:
Unidades físicas. Aquellas que se expresan en relación al peso y al volumen de la solución, en forma porcentual (se multiplican por 100). Por ejemplo:
- %Peso/peso. Se expresa en gramos de soluto sobre gramos de solución.
- %Volumen/volumen. Se expresa en centímetros cúbicos (cc) de soluto sobre cc de solución.
- %Peso/volumen. Combina las dos anteriores: gramos de soluto sobre cc de solución.
Unidades químicas. Aquellas que se expresan en sistemas de unidades químicas. Por ejemplo:
- Molaridad (M). Se expresa en número de moles de soluto sobre un litro de solución o un kilogramo de solución. Se calcula de la siguiente manera:
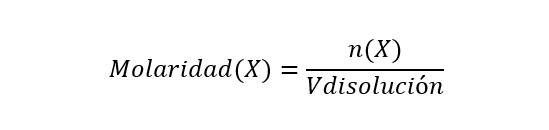
Donde n(X) es la cantidad de moles del componente X y Vdisolución es el volumen de la disolución. La molaridad se expresa en moles/Ldisolución.
- Fracción molar (Xi). Se expresa en términos de moles de un componente (solvente o soluto) en relación con los moles totales de la solución, de la siguiente manera:
Xsolución = moles de soluto / (moles de soluto + moles solvente)
Xsolvente = moles de solvente / (moles de soluto + moles solvente)
Siempre contemplando que:
Xsolvente + Xsolución = 1
La fracción molar es adimensional, es decir, no se expresa en unidades de medición.
- Molalidad (m). Es la proporción entre el número de moles de cualquier soluto disuelto por kilogramos de disolvente. Se calcula de la siguiente manera:
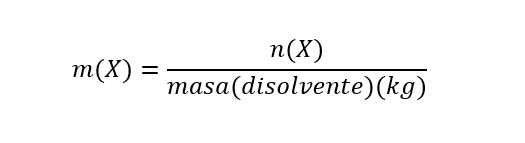
Donde m(X) es la molalidad de X, n(X) es el número de moles de X y masa(disolvente) es la masa de disolvente expresada en kg. Es importante aclarar que la molaridad se expresa por kg (1000g) de disolvente. Se expresa en unidades de mol/kg.
Concentración
La concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolución o, a veces, de disolvente; donde el soluto es la sustancia que se disuelve, el solvente es la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el solvente, menos concentrada está la solución, y a mayor proporción más concentrada está.
Expresión cualitativa y cuantitativa de la concentración
La expresión cuantitativa de la concentración corresponde a la medida en las distintas unidades de concentración de mezcla que existen en la química Cómo puedo hacer la molaridad, la normalidad, el peso sobrepeso, pesó sobre volumen, la molalidad entre otros...
La expresión cualitativa que tiene la concentración dentro de la química se clasifica principalmente en una mezcla saturada insaturada o sobresaturada.
La molalidad es la relación que existe entre el número
de moles de cualquier soluto disuelto por kilogramos de
disolvente(m). La unidad kilogramo se utiliza a escala
industrial, sin embargo para los experimentos que se
realizan en los laboratorios químicos, se puede utilizar
además como unidad de medida el gramo.
Por tanto decimos que la molalidad (m) es el número de moles de soluto por
kilogramo de disolvente (no de disolución).
se calcula :
m= moles de soluto/ kilogramos de solvente
NORMALIDAD
La concentración Normal o Normalidad, es el número de
pesos equivalentes por litros de solución. , por lo tanto si una solución contiene un peso equivalente de CaCO3 (100 g), en un litro de solución, su concentración es 1 Normal.
se calcula:
N = g de soluto / (PM/n) : litros de solución





Comentarios
Publicar un comentario